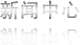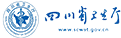政策法規(guī)
CDE藥品審評(píng)周報(bào)(2015.7.5-2015.7.11)
作者: 來(lái)源:神宇醫(yī)藥 日期:2015-07-16 10:54:27
CDE藥品審評(píng)周報(bào)(2015.7.5-2015.7.11)
在審評(píng)
本周(2015.7.5-2015.7.11)有123個(gè)藥品(按受理號(hào)計(jì))進(jìn)入在審評(píng)狀態(tài),其中115個(gè)化藥,4個(gè)中藥,3個(gè)治療用生物制品,1個(gè)預(yù)防用生物制品。
重點(diǎn)如下:
1.注射用D(-)磺芐西林鈉:磺芐西林是一種廣譜半合成青霉素類抗生素,對(duì)多種革蘭陰性菌、對(duì)部分革蘭陽(yáng)性菌和厭氧菌具有抗菌作用。D(-)磺芐西林鈉是磺芐西林鈉的一種異構(gòu)體,由湖南三清藥業(yè)有限公司1.3類申報(bào),目前已處于排隊(duì)在審評(píng)狀態(tài)。
2.鹽酸美金剛口溶膜:鹽酸美金剛是一種電壓依賴性、中等程度親和力的非競(jìng)爭(zhēng)性NMDA(N-甲基-D-天冬氨酸)受體拮抗劑。它可以阻斷谷氨酸濃度病理性升高導(dǎo)致的神經(jīng)元損傷,用于治療中重度至重度阿爾茨海默型癡呆。目前國(guó)內(nèi)只有鹽酸美金剛片和口服液上市,而申報(bào)中有膠囊、口崩片、分散片、注射劑等,本次齊魯制藥有限公司獨(dú)家申報(bào)另一個(gè)新劑型-口溶膜,由于目前本品上市廠家較少,而本品市場(chǎng)巨大,因此以后哪種劑型更占優(yōu)勢(shì)還未知。
3.PT010:本品由Pearl開發(fā)(后被阿斯利康收購(gòu)),是一種治療COPD的藥物,暫未上市。PT010是一種三方制劑,由一種長(zhǎng)效β2-受體激動(dòng)劑富馬酸福莫特羅、一種M受體拮抗劑格隆溴銨和一種吸入型糖皮質(zhì)激素組成,其中前兩種藥品是一種該公司的復(fù)方制劑PT003。目前,本品由Pearl在國(guó)內(nèi)首次進(jìn)口申報(bào)臨床。
4.注射用重組人源化抗HER2單克隆抗體-美登素偶聯(lián)物:本品是一種藥物-抗體偶聯(lián)物物(ADC),由百奧泰生物科技(廣州)有限公司1類申報(bào)。目前國(guó)內(nèi)由重組人源化抗HER2單克隆抗體組成的1類ADC還有注射用重組人源化抗HER2單克隆抗體-MMAE偶聯(lián)劑。在美國(guó)已有類似的藥物上市,即羅氏開發(fā)的商品名為Kadcyla的一種曲妥珠單抗-emtansine注射液,用于治療乳腺癌。
在審批
本周共42個(gè)藥物進(jìn)入審批程序,其中35個(gè)化藥,3個(gè)中藥,3個(gè)治療用生物制品,1個(gè)預(yù)防用生物制品。重點(diǎn)如下:
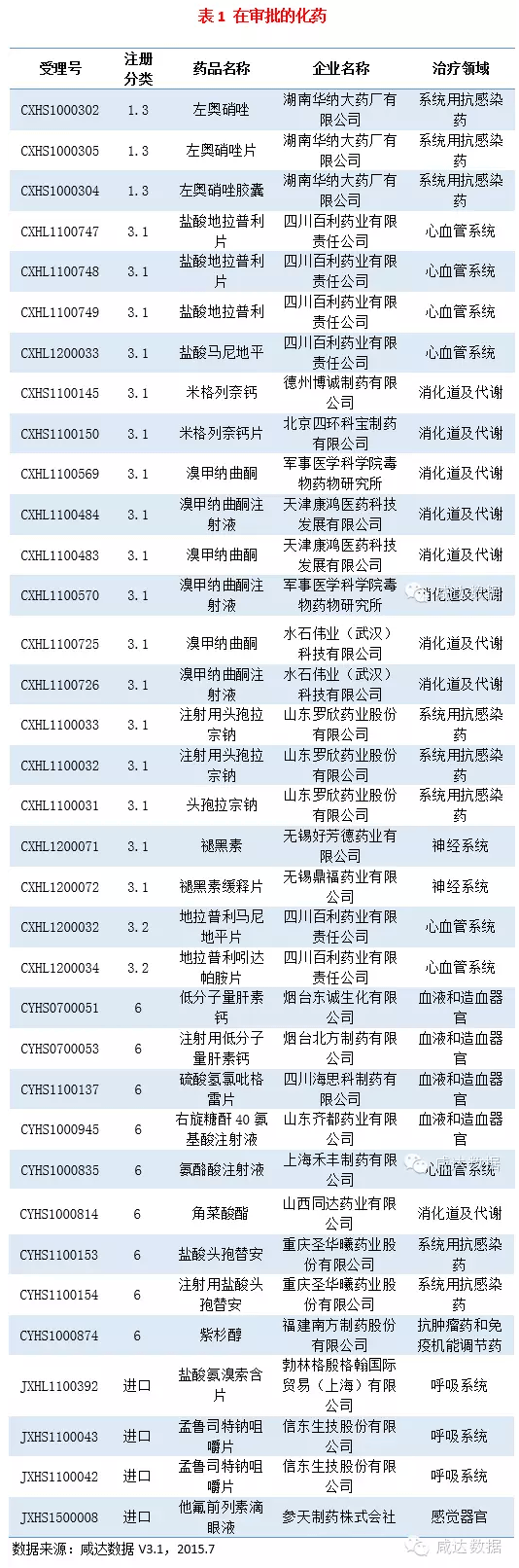
1.左奧硝唑:湖南華納大藥廠有限公司1.3類申報(bào)的左奧硝唑原料、片及膠囊劑已完成三合一審評(píng),正在進(jìn)行三合一審核,不日就會(huì)批產(chǎn)。目前國(guó)內(nèi)申報(bào)左奧硝唑的不止一家,劑型包含口服和注射,注射劑已經(jīng)由南京圣和在2009年率先上市,此外,南京圣和的口服片劑也處于現(xiàn)場(chǎng)核查階段,但是,華納大藥廠更快一步,有望成為第一家上市本品口服制劑的企業(yè)。2.米格列奈鈣:本品是一種胰島素促泌劑,用于治療2型糖尿病,目前國(guó)內(nèi)已有5家上市米格列奈鈣片,其中1家進(jìn)口。此次北京四環(huán)科寶制藥有限公司聯(lián)合德州博誠(chéng)制藥有限公司3.1類申報(bào)本品,已完成三合一審評(píng),正在進(jìn)行三合一審核,推測(cè)不久也要上市了。
3.低分子量肝素鈣:本品是肝素的降解物,在外科手術(shù)中,用于靜脈血栓形成中度或高度危險(xiǎn)的情況,預(yù)防靜脈血栓栓塞性疾病。目前國(guó)內(nèi)已有多家上市低分子肝素,包括其鈉鹽和鈣鹽,而與注射用低分子量肝素鈣這個(gè)通用名相同的只有1家。本次由煙臺(tái)北方制藥有限公司和煙臺(tái)東誠(chéng)生化有限公司聯(lián)合申報(bào)的本品原料和制劑已完成三合一審評(píng),即將在低分子肝素這個(gè)“混亂”的市場(chǎng)上,再加一腳。
此外,百時(shí)美施貴寶的PD-L1抑制劑Nivolumab注射液在國(guó)內(nèi)首次獲批臨床。上海新興醫(yī)藥股份有限公司的加快品種人凝血因子Ⅷ正在進(jìn)行三合一審核,即將批產(chǎn)。
在審批的藥物信息見附表1。
審批完畢
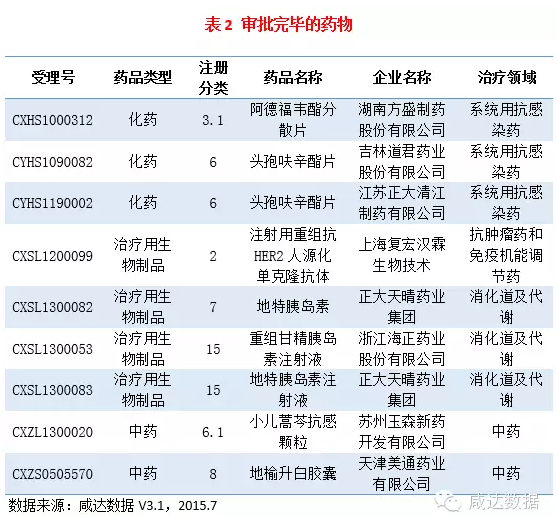
本周有9個(gè)藥物審批完畢,其中3個(gè)化藥,2個(gè)中藥,4個(gè)治療用生物制品。其中天津美通藥業(yè)有限公司的地榆升白膠囊批準(zhǔn)生產(chǎn)。上海復(fù)宏漢霖生物技術(shù)有限公司的2類生物制品注射用重組抗HER2人源化單克隆抗體獲批臨床。
審批完畢的藥物信息見附表2。
制證完畢
本周制證完畢的藥物共47個(gè),其中25個(gè)藥化,17個(gè)中藥,4個(gè)治療用生物制品,1個(gè)預(yù)防用生物制品。本周多個(gè)中藥獲批生產(chǎn),國(guó)家局不知怎么了,一口氣制證了9個(gè)中藥的生產(chǎn)批件。此外,百慕大先靈葆雅(中國(guó))有限公司北京代表處進(jìn)口申報(bào)的治療用生物制品絨促卵泡素α注射液獲批臨床。
制證完畢的藥物見附表3和表4。